Contente
- Principal diferença
- Protonação vs. Deprotonação
- Gráfico de comparação
- O que é Protonação?
- O que é a desprotonação?
- Principais diferenças
- Conclusão
Principal diferença
A principal diferença entre protonação e desprotonação é que a protonação é a adição de um próton a um composto químico, enquanto a desprotonação é a eliminação de um próton de um composto químico.
Protonação vs. Deprotonação
Protonação é o processo químico que ocorre durante as reações químicas nas quais um próton adiciona um composto químico; por outro lado, a desprotonação é o processo que ocorre durante a reação química em que o próton se remove de um composto químico. Protonação é o aumento da carga +1 em um átomo, molécula, íon ou composto; por outro lado, desprotonação é a diminuição da carga +1 do átomo, íon, molécula ou composto.
O átomo, molécula ou um composto envolvido na protonação é chamado base; Por outro lado, o átomo, molécula ou um composto envolvido na desprotonação é chamado ácido. Protonação é o processo no qual o pH do composto químico aumenta; pelo contrário, a desprotonação é o processo no qual o pH da solução de um composto químico diminui.
Protonação é o processo de adição, enquanto a desprotonação é a remoção ou eliminação do processo. Protonação é o processo químico no qual a energia adicionada nas reações químicas; por outro lado; desprotonação é o processo químico no qual a energia liberada durante as reações. Em outras palavras, protonação é a adição de H+ no composto químico; por outro lado, desprotonação é a remoção do H+ de um composto químico.
A protonação aumenta a carga do átomo, íon ou molécula; Por outro lado, a desprotonação diminui a carga do íon, átomo ou molécula. As bases sempre passam por processos químicos da protonação durante as reações ácido-base; por outro lado, os ácidos sempre passam pelos processos químicos da desprotonação durante as reações ácido-base.
Protonação é o processo químico de produção de ácidos conjugados durante os processos químicos; por outro lado; desprotonação é o processo químico de produção da base conjugada durante o processo químico. A protonação sempre causa a produção de moléculas de água a partir dos grupos hidroxila do composto nos processos químicos; Por outro lado, a desprotonação sempre causa a produção de moléculas de hidroxila a partir das moléculas de água nos processos químicos.
A protonação é um processo químico muito rápido durante as reações orgânicas; por outro lado, a desprotonação é um processo muito lento durante as reações orgânicas. Protonação é o processo químico que estimula o processo de isomerização, enquanto o processo químico que estimula o processo de isomerização. Protonação é a taxa crescente de caráter ácido; Por outro lado, a desprotonação é a taxa crescente de caráter básico.
Gráfico de comparação
| Protonação | Desprotonação |
| A protonação é a adição de um próton em um composto químico. | A desprotonação é a eliminação de um próton de um composto químico. |
| Prótons | |
| Prótons adicionar em um composto | Prótons removidos do composto |
| Carregar | |
| Aumenta a carga +1 da molécula | Diminui a carga +1 da molécula |
| Taxa de acidez ou basicidade | |
| Taxa de basicidade | Taxa de acidez |
| O pH do composto | |
| Aumenta o pH do composto | Diminui o pH do composto |
| Velocidade do processo | |
| É um processo rápido | É um processo lento |
| Processo de isomerização | |
| Estimula o processo de isomerização | Inibir o processo de isomerização |
| A energia do processo | |
| Acrescenta a energia à reação | Libera a energia das reações |
| Tipo de Processo | |
| Processo de adição | Processo de eliminação |
| H+ Íon | |
| Os íons hidrogênio são adicionados ao composto | Os íons hidrogênio eliminam do composto |
| Reversibilidade | |
| É o processo reversível | É o processo irreversível |
| Capacidade Catalítica | |
| Tem o poder catalítico | Não possui poder catalítico |
O que é Protonação?
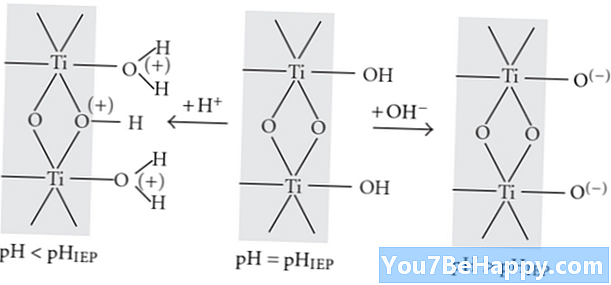
Protonação é o processo químico da adição de um próton nos compostos químicos durante as reações químicas. É um processo muito rápido. Pode formar as moléculas de água a partir das moléculas de hidroxila. A protonação é o processo reversível que aumenta a carga do composto químico em uma taxa de carga +1 em um átomo, íon, moléculas ou espécie.
O pH das soluções ou solventes envolvidos na protonação é muito baixo. Protonação é a taxa de basicidade ou acidez dos compostos químicos ou orgânicos. Protonação é a adição ou processo endotérmico envolvido no processo de isomerização. Também estimula o processo de polimerização.
Possui o poder catalítico de aumentar a acidez das reações usadas em vários processos, como reações de adição, reação nucleofílica, eletrofílica, reações de substituição, etc. O processo de protonação é proporcional ao grau do caráter ácido da substância. Geralmente envolve a formação das moléculas de água durante o processo.
Os íons hidrogênio sempre são adicionados ao composto químico durante o processo de protonação. Ele também tem sua capacidade de variar as características ópticas da molécula. O processo de protonação dos compostos depende da acidez dos ácidos disponíveis nas soluções ou nos solventes. O processo de protonação é usado para diminuir a reatividade das moléculas orgânicas. A protonação geralmente é conhecida como o processo endotérmico que envolve liberar a energia doando o próton para as espécies químicas com muita facilidade.
O processo como a adição de hidrogênio na molécula de amônia, que resulta na formação de íons de amônio, a adição de íons de hidrogênio nas moléculas de água para produzir os íons hidrônio, a protonação do íon hidroxila para formar as moléculas de água, a adição de íons hidrogênio aos álcoois para formar os íons hidrônio na solução, a adição de íons hidrogênio aos alcenos e alcinos, etc., explica melhor o termo protonação.
O que é a desprotonação?
A desprotonação é o processo químico de eliminação dos prótons dos compostos químicos durante as reações químicas. É um processo lento. Este processo também tem sua capacidade de formar íons hidroxila a partir das moléculas de água. A desprotonação é o processo irreversível que tem a capacidade de diminuir a carga do composto químico em uma taxa de +1 na carga de um átomo, molécula ou espécie de íon.
O pH das soluções ou solventes envolvidos no processo de desprotonação é muito alto. Este processo não tem sua capacidade de realizar reações químicas, agindo como um catalisador. O processo de protonação é proporcional ao caráter básico da substância. Os íons hidrogênio sempre eliminam do composto químico durante o processo de desprotonação. Suas atividades ópticas também são variáveis.
O processo de desprotonação também depende do pH das soluções ou solventes. Este processo aumenta a reatividade das moléculas orgânicas. Os processos como a remoção de íons hidrogênio da água para formar íons hidroxila, a remoção de um próton dos alcanos para formar os alcenos e alcinos, a remoção de íons hidrogênio dos álcoois, etc. melhor explicam o termo desprotonação.
Principais diferenças
- Protonação é o fenômeno da adição de prótons; por outro lado, a desprotonação é o fenômeno da remoção de prótons.
- A protonação sempre aumenta o pH da solução química; Por outro lado, a desprotonação sempre diminui o pH da solução química.
- A protonação sempre adiciona a carga +1 ao composto químico; por outro lado, a desprotonação sempre remove a carga +1 do composto químico.
- Protonação é a taxa crescente de caráter ácido; Por outro lado, a desprotonação é a taxa crescente de caráter básico.
- A protonação ocorre muito rapidamente; por outro lado, a desprotonação ocorre muito lentamente.
- Bases geralmente usadas no processo de protonação ao aceitar o próton; pelo contrário; desprotonação geralmente usada no processo de desprotonação removendo os prótons.
- A adição de energia ocorre no processo de protonação; Por outro lado, a remoção de energia ocorre no processo de desprotonação.
- A protonação aumenta a carga do átomo, íon ou molécula; Por outro lado, a desprotonação diminui a carga do íon, átomo ou molécula.
- O processo de protonação envolve a isomerização das substâncias químicas; por outro lado, o processo de desprotonação não envolve a isomerização das substâncias químicas.
- Protonação é o processo químico que ocorre nas bases durante as reações ácido-base; Por outro lado, a desprotonação é o processo químico que ocorre nos ácidos durante as reações ácido-base.
- A protonação sempre produz o ácido conjugado no processo químico; pelo contrário, a desprotonação sempre produz a base conjugada no processo químico.
- A protonação torna a solução mais concentrada; Por outro lado, a desprotonação torna a solução menos concentrada.
- A protonação envolve a fabricação das moléculas de água; por outro lado, a desprotonação envolve a fabricação das moléculas de hidroxila.
- Protonação é o processo endotérmico; por outro lado, a desprotonação é o processo exotérmico.
Conclusão
A discussão acima conclui que a protonação é o aumento da carga +1 do composto químico; por outro lado, desprotonação é a diminuição na carga +1 do composto químico.

